媒体揭秘:滴血查癌的清华教授罗永章何许人也?(组图)
发布时间:2017-05-09 11:26 | 来源:澎湃新闻 2017-05-04 18:36 | 查看:2534次
五一假期,《央视新闻》、《人民日报》以及央视“经济半小时”节目同时发布一则消息“重大突破!一滴血可测癌症,已被批准临床使用!中国制造!”,孰料,这三个感叹号的新闻报道却成败笔,引来众多专业人士和媒体纷纷质疑其“误导公众”“虚假宣传”。
事实上,被视为“重大突破”的热休克蛋白90α定量检测试剂盒,早在2013年就被国家食品药品监督管理局(CFDA)批准,只不过在这个劳动节得到央视多个栏目集体关注,而且特别强调这项技术是“中国制造”。到底这项成果能不能检测癌症、真正造福于患者呢?作出“历史性突破”的罗永章又是何许人?
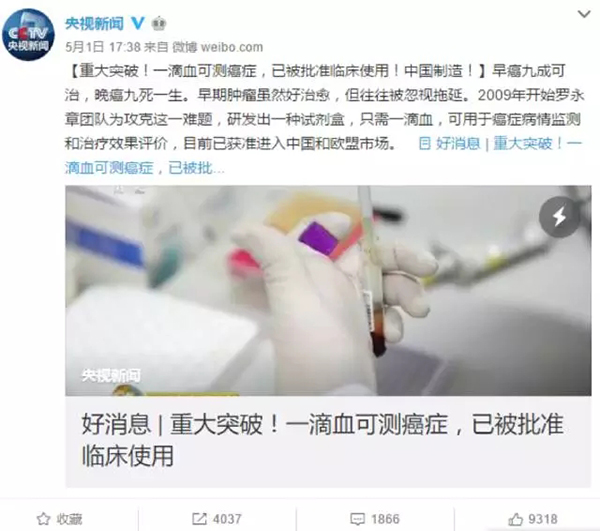
央视的报道获得了大量的转发和评论,也有评论者表示,该报道应严谨些。本文图片 知识分子微信公众号

《人民日报》拥有超高的人气,让这则新闻拥有很高的关注度。
“滴血验癌”遭质疑
2013年11月28日,科学网博主王守业博士就曾对“清华教授发现全新肿瘤标志物研发试剂可测癌症”的新闻表示强烈质疑。
几年过去,“滴血验癌”的新闻再次登上央视报道,让如今任华人抗体协会会长的王守业不免感慨万分,他贴上旧文不愿再做评论,只是重申文责自负。
所谓“滴血验癌”的热休克蛋白90α定量检测试剂盒采用酶联免疫法技术(ELISA),已经是一项非常成熟的技术,利用特异性强的抗原-抗体反应,即使待检测的血液中只有很少量的肿瘤抗原,也可利用此方法检测出来。王守业认为,滴血只不过是用来宣传该技术的噱头而已。
一位不愿透露姓名的业内人士告诉《知识分子》,真正的一滴血检测是像测血糖那样只需刺破指尖,将一滴指尖全血放在试纸上,马上插进血糖仪检测,血糖读数马上显示。而烟台普罗吉生物科技发展有限公司的这个Hsp90α产品用的是酶联免疫法,其操作必须是先抽取几毫升静脉血,然后离心分离出血清/血浆,再从中取出50-100微升放入酶标板反应孔,经反复孵育洗涤后才能置于酶标仪中检测。把这么一个复杂的检测过程,说成“一滴血”,是在偷换概念,误导人们接受。

疑似罗永章教授的微博账号5月1日晚对此新闻进行专门回复,“一滴血检测肿瘤’的说法很不准确,确切地讲,应该叫‘监测肿瘤’”。
诊断意义有限
“监测”与“检测”虽是一字之差,但是在临床上的意义则相去甚远。监测仅仅是评估概念,而检测则是诊断概念,强调的是发现肿瘤。
值得注意的是,热休克蛋白90α定量检测试剂盒(酶联免疫法)2013年获得注册证。国家药监局注册批文明确指出的使用范围是“本产品用于定量检测非放疗肺癌患者EDTA-K2抗凝血浆中的热休克蛋白90α,该指标用于对已明确为肺癌患者的病情监测和疗效评价。”说明该产品注册报批时的临床试验对象只是已确诊的未经治疗的肺癌患者。
中国工程院资深院士孙燕教授早在2016年2月发表的《不推荐将血清标志物用于无症状人群或高危人群的肺癌筛查》文章中,很直接地对话罗永章,说:“我在清华大学的一个朋友发现热休克蛋白在肿瘤患者中阳性率为80%以上,而在正常人中阳性率为10%~20%左右,遂隐约地称发现一个很好的肿瘤早诊断指标。他就是将监测指标与诊断指标二者的概念混淆了。也许这个热休克蛋白是有用的,但是其实验结果中既存在假阳性又存在假阴性,所以没有任何诊断价值。”
实际上,在2013年11月17日清华大学生命学院宣布罗永章教授在国际上首次发现全新的肿瘤标志物—热休克蛋白90α(Hsp90α)的重大突破消息后,就曾引发国内外学界的大量质问,几天后罗永章不得不出面澄清,他并没有说其研发的Hsp90α定量检测试剂盒可以筛查各种癌症,而是强调正确的说法应该是“Hsp90α定量检测试剂盒是Hsp90α蛋白被发现24年来,全球首个将其用于临床的产品,对于提高肿瘤患者的病情监测和疗效评价水平、实现肿瘤个体化治疗具有重要推动作用。”
Hsp90α获得国家第三类(最高类别)医疗器械证书是怎么回事?
在清华大学生科院网站上,该报道称产品获得国家药监局最高级别的III类认证,但实际上只要相关产品涉及癌症,就必须申报国家药监局III类注册申报。(更多内容请见CFDA: http://www.sda.gov.cn/WS01/CL0053/103757.html )一个显见的事实是,全国范围内获得III类注册证的生产销售企业何止千万。

2013年,罗永章教授向外界发布科研成果。

体外诊断试剂注册管理办法。图片截自CFDA网站
Hsp90α在肿瘤筛查方面价值有多大?
热休克蛋白90α定量检测试剂盒目前可应用于定量检测非反射肺癌、肝癌患者EDTA-K2抗凝血浆中的热休克蛋白90α,以此作为肺癌、肝癌患者的病情监测和疗效评价。在近日的“经济半小时”节目中,中国工程院院士程京也表示,热休克蛋白90α可预测肺部的远端转移,可帮助医生判断肿瘤是否已经发生远端转移,对他们临床判断和诊断有帮助。
上述业内人士表示,热休克蛋白90a用于肺癌的预后评估和疗效监测的确是有用的新产品,最近陆续在各地医院推广也着实不易,为医生诊治肺癌症患者提供了新武器,是好事。但学界批评的是把这个新产品用途夸大用于癌症筛查就错了,业界专家曾一针见血地指出,滥用90a等肿瘤标志物进行健康体检“无异于谋财害命!”“我们在体外诊断这个圈子工作多年,略为了解一些真相,写出给各位同事和亲朋好友是怕各位受人鼓动花冤枉钱”。
目前临床上公认的肝癌生物标记物为临床公认的肝癌标志物甲胎蛋白(AFP),根据报道称,热休克蛋白90α可检测出AFP检测结果为阴性的肝癌患者,检出率高达94%,并且能在肝癌早期检测中发挥作用。
截至目前,与热休克蛋白90α有关在进行中的临床试验有3项,称其为一种广谱肿瘤标志物,还有待进一步的研究和证实,如果把这个新产品用途夸大,宣传其广泛用于癌症筛查就与事实有违。
目前,针对不同种类的肿瘤生物标记物多达数十种,热休克蛋白90α只不过是其中的一种,它对癌症的早期诊断具有一定价值,但强调它具有重大突破以及属于世界难题,显然有夸大之嫌。合适的肿瘤标记物,能够更早期地发现肿瘤进展情况,但CT和B超仍是检测肿瘤的金标准,生物标记物只不过是一种有效的辅助检测手段,不宜夸大其作用和价值。
值得一提的是,尽管2013年热休克蛋白90α定量检测试剂盒被CFDA批准生产,但根据负责生产该试剂盒的烟台普罗吉生物科技发展有限公司管理层在“经济半小时”节目中透露,其目前仍未解决生产问题。
罗永章其人其事
2013年在清华大学召开新闻发布会宣布“重大突破”之后,罗永章遭到国内外学术界的一片质疑。
王守业在随后的博文中梳理道,罗永章教授于2009年才开始有了第一篇有关Hsp90α的论文,并没有证据表明他在“国际上首次发现Hsp90α为一个全新的肿瘤标志物”,早在他之前就有很多研究者对热休克蛋白90α进行了研究,罗永章教授在这个领域既不是首创者,也很可能不是最有影响的学者。
前述业内人士在日前向《知识分子》表示,热休克蛋白整个家族,包括90α早被国内外学者证实。1989年,Weber课题组首次报道了人Hsp90α的全长基因序列,使该蛋白的身份得到了确认。1992年,Ferrarini课题组发现,人Hsp90α能被肿瘤细胞分泌到细胞外,可以作为肿瘤标志物。2002年,Neckers研究室发表论文证明Hsp90α在转移癌患者的血液含量升高。
罗永章是抗肿瘤蛋白质药物国家工程实验室主任,该实验室名誉主任由两院院士周光召和DNA双螺旋结构发现者之一詹姆斯·沃森(James D. Watson)共同担任。在媒体报道中,不乏沃森赞赏罗永章工作的表述。
实际上,在2013年清华举行的新闻发布会上沃森确曾致信罗永章表示祝贺:“你已经稳固地建立了Hsp90α作为肿瘤标志物的概念,并成功地研发出这一蛋白的定量检测试剂盒、在中国用于临床监测。祝贺你、你的团队和清华大学,能够在这么短的时间里取得了如此巨大的成就!”

罗永章与沃森合影。图片来自tsinghua.edu.cn
前述业内人士提醒道,沃森肯定的是Hsp90α作为肿瘤标记物,在临床上的价值,至于Hsp90α试剂盒是否可以广泛检测各种癌症,显然这需要更多的临床数据进行支持,才可定论。他进一步强调,在此前的2009年,沃森还推荐了罗永章教授在美国做访问学者时所参与的一项小鼠研究,论文发表在《美国科学院院刊》(PNAS)上,该研究通过体外培养的肺腺癌细胞系和小鼠的转移肺癌模型,研究Hsp90α在转移癌细胞分泌上的机制和作用,这是一篇基于小鼠的基础性的研究,并无任何临床资料。
在罗永章的研究生涯中,另外一项被质疑的工作是其研发的国家一类新药、也被称为“世界级抗癌新药”——恩度。
美国科学家犹大·福克曼(Judah Folkman)是血管紧缩素(Angiostatin)和血管内皮抑制素(Endostatin)的最早发现者。1991年,他发现了这两种蛋白质,于是开始通过他创立的公司EntreMed对它们进行研发。
1999年,罗永章回国,开始着手基于血管内皮抑制素的新药研发,并在烟台创建了麦得津生物工程股份有限公司,担任首席科学家。他知道Endostatin的性质不稳定,通过添加几个氨基酸,使其性质稳定下来。2003年,其成功研制抑制血管生长新药——恩度,之后被评为“2005年中国十大科技新闻”。
Folkman一开始并不知道罗永章在研究他发现的蛋白Endostatin,直至在一次报告中获知,然后他通过实验室一名中国科学家联系罗永章,并要到了一些药物恩度。他发现恩度的确效果比Endostatin强。
根据《华尔街日报》2005年的报道,由于研发Endostatin成本太高,且其在体外性质不稳定,容易分解,最为重要的是,其并不能给患者带来很大的收益,EntreMed后来不得不放弃了,并将专利转让给波士顿儿童医院。
罗永章有意打入美国市场,但如果该药物想要进入美国市场,显然会面临专利纠纷。“由于恩度与Endostatin的结构非常相似,波士顿儿童医院拥有Endostatin专利,涉及蛋白制备方法、肿瘤治疗等方面,如果恩度打算进入美国市场,需要通过专利许可”。波士顿儿童医院知识产权经理Leslie Grushkin-Lerner表示。

Folkman申请的Endostatin专利。

恩度的中国专利。

恩度申请的美国专利,但是仍以修饰的Endostatin的名义申请。
恩度从I期临床试验到CFDA批复生产,只用了4年时间,可谓速度惊人,当时恩度获得了国家的全力扶持。2006年9月,先声药业仅以2亿元获得麦得津生物的80%股份,随后恩度被先声药业推入市场。但是无论从药物效果以及市场反馈都不尽如人意。看来先声药业并没有在这笔看似有利于己方的交易中占到很多便宜。


恩度虽然同时拥有中国和美国专利,但它如果进入美国市场仍然受限于Endostatin的专利限制。
目前,该药被批准用于治疗非小细胞肺癌,根据介绍,其联合用药晚期NSCLC患者的中位生存时间延长至17个月左右,但有专家表示,其单药对肺癌患者的客观反应率仅3%左右,差不多相当于“维生素的效果”。
2012年,“恩度”销售额约为2亿元,近几年增速也并不明显。同国外抗癌药物,甚至国内主要抗癌药物相比,销售额相形见绌。其真正给患者带来的福祉也很有限。一位业内人士评价道,这绝非首创,技术上也没有创新。
(编者注:原文标题为《清华大学罗永章的“一滴血查癌”受媒体热捧,他到底是何许人》)




发表评论
网友评论
查看所有评论>>